Коррозия при контакте разнородных металлов
Детали, изготовленные из разных металлов, при эксплуатации в реальных условиях часто находятся в контакте друг с другом. В состав самих металлов часто вводят различные легирующие добавки, которые помимо придания необходимых свойств, также призваны защищать металл от коррозии. Не редко металлические изделия покрывают защитными покыртиями, например, из цинка, алюминия, кадмия. Все эти факторы вызывают явление, названное контактной коррозией.
При контакте с водой начинается электрохимическое растворение металла. Разные металлы растворяются с разной интенсивностью, поэтому была введена величина, характеризующая интенсивность растворения, – электродный потенциал. Электродные потенциалы для некоторых металлов приведены в таблице 1.
Таблица 1 – Стандартные электродные потенциалы некоторых металлов
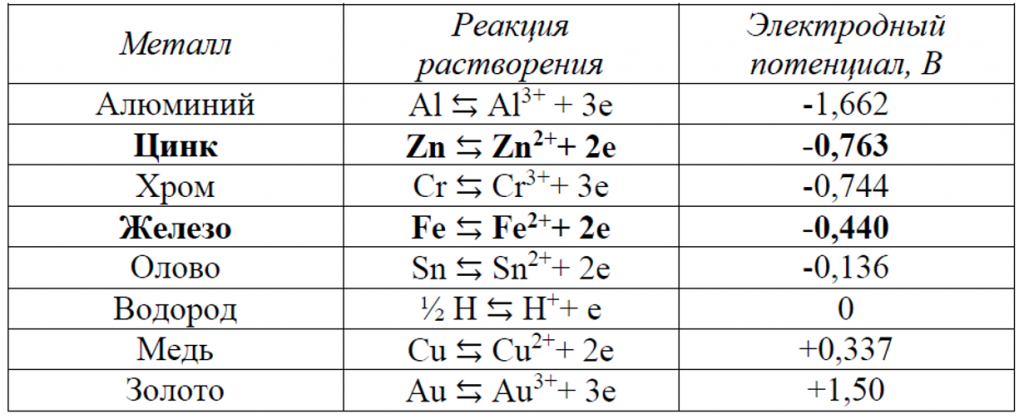
Обратите внимание на распределение металлов в таблице. Чем положительней потенциал, тем благороднее металл и тем меньше он подвержен коррозии. Что же происходит при контакте металлов с разным электродным потенциалом?
При контакте двух разных металлов электроны от металла с более отрицательным электродным потенциалом переходят к металлу с более положительным электродным потенциалом. Начинается процесс подобный тому, который происходит внутри батарейки. Электроны от «плюса», менее благородного металла, протекают к «минусу», более благородному металлу. В результате этого скорость коррозии «плюса» возрастает, а скорость коррозии «минуса» замедляется.

Рисунок 1 – Гальваническое цинковое покрытие
Это явление может иметь как положительный, так и отрицательный эффект. Рассмотрим сперва положительный эффект. Обратите внимание на таблицу, а именно на цинк и железо. Для защиты стальных деталей часто используют цинковые покрытия (рис. 1). Цинк имеет более отрицательный потенциал чем железо, а значит цинк будет растворяться в первую очередь, что позволит изделию из стали дольше избегать коррозии. Последствие подобного явления представлено на рисунке 2, где изображены шайбы и винты в цинк-ламельном покрытии после коррозионных испытаний. На рисунке не видно бурых очагов коррозии железа, а видна только белая коррозия цинка.
Рисунок 2 – Цинк-ламельное покрытие после испытаний
Теперь рассмотрим отрицательный эффект взаимодействия разнородных металлов.
Рисунок 3 – Контакт стального и медного изделия
Рисунок 4 – Контакт алюминиевой детали и стального винта
Взгляните снова на таблицу и посмотрите на положение железа и алюминия, меди и железа. Потенциал железа больше потенциала алюминия, а потенциал меди больше потенциала железа. Следовательно, контакт железа и алюминия вызовет коррозию алюминия (рис 4), а контакт меди и железа – коррозию железного изделия (рис 3). Поэтому следует избегать использования стального крепежа для соединения алюминиевых изделий и наоборот.
На рисунке 5 показана коррозия стального гвоздя при контакте с медной проволокой. Для удобства наблюдения за растворением железа система была помещена в индикаторный раствор красной кровяной соли. Красная кровяная соль реагирует с ионами железа, образуя соединения сине-зелёного цвета.
Рисунок 5 – Коррозия стального болта при контакте с медью
ГОСТ 9.005-72 «Металлы, сплавы, металлические и неметаллические неорганические покрытия. Допустимые и недопустимые контакты с металлами и неметаллами» наиболее полно регламентирует возможность использования разнородных металлов в контакте друг с другом.



